近日,我院副院長(zhǎng)唐健元在《ACS AMI》雜志發(fā)表重要學(xué)術(shù)成果:聲光聯(lián)合驅(qū)動(dòng)下中藥蟾酥與納米技術(shù)的新“結(jié)合”有效治療肝癌。以下為相關(guān)研究成果。
中藥蟾酥在治療肝癌中的應(yīng)用潛力
肝癌古稱“肝積”,中醫(yī)藥在治療“癥瘕積聚”類(lèi)疾病有悠久歷史。中醫(yī)藥治療肝癌多遵循“辨證施治”原則,采用“攻補(bǔ)兼施”的方法,常與其他療法配合應(yīng)用,以提高機(jī)體抗病力,改善全身狀況和癥狀,減輕放化療不良反應(yīng)。中醫(yī)典籍多記載蟾酥能治療“惡瘡”、“惡腫”、“積塊”,即現(xiàn)代醫(yī)學(xué)研究中的抗腫瘤作用,如《本草綱目》記載蟾酥:“治發(fā)背疔瘡,一切惡腫”;《本草匯言》記載到:“蟾酥,療疳積,消膨脹,解療毒之藥也,能化解一切瘀郁壅滯諸疾,如積毒、積塊”。目前研究認(rèn)為蟾毒靈(BF)是蟾酥抗腫瘤作用的主要活性成分,具有抑制腫瘤細(xì)胞增殖及血管生成、誘導(dǎo)腫瘤細(xì)胞凋亡及分化、逆轉(zhuǎn)腫瘤細(xì)胞多藥耐藥性、調(diào)節(jié)機(jī)體免疫功能等多方面抗腫瘤作用。
聲光聯(lián)合驅(qū)動(dòng)下的外界物理輔助治療
聲和光是自然界中最常見(jiàn)的現(xiàn)象,又是極好的刺激反應(yīng)性治療介質(zhì),具有非侵入性、選擇性好、毒性低等優(yōu)點(diǎn),在抗腫瘤研究中呈現(xiàn)出巨大的優(yōu)勢(shì)及潛力。聲動(dòng)力學(xué)治療(SDT)作為一種具有潛在療效的非侵入性腫瘤治療方法,具有高度的腫瘤特異性、可控性、理想的治療效果和對(duì)正常器官/組織的損害小等優(yōu)點(diǎn)。當(dāng)超聲(US)能量觸發(fā)時(shí),聲敏劑可以被激活以產(chǎn)生有毒的活性氧(ROS)可促進(jìn)腫瘤細(xì)胞凋亡和壞死。所以,SDT治療依賴于組織中氧氣的可用性。到目前為止,已經(jīng)出現(xiàn)了幾種緩解腫瘤缺氧的策略,例如通過(guò)溫和的光熱效應(yīng)增加腫瘤內(nèi)血液供應(yīng),將更多的O2輸送到腫瘤組織中等。光熱療法(PTT)利用物理能量使局部組織升溫,誘導(dǎo)腫瘤細(xì)胞凋亡或壞死。更長(zhǎng)波長(zhǎng)的NIR-II(1000 nm-1350 nm)窗口,其允許更大的最大允許曝光和理想的組織穿透深度已日漸成為研究重點(diǎn)。
聲光聯(lián)合驅(qū)動(dòng)下通過(guò)誘導(dǎo)細(xì)胞凋亡治療肝癌
我院副院長(zhǎng)唐健元,成都中醫(yī)藥大學(xué)孟祥瑞、劉靜雯與電子科技大學(xué)劉貽堯教授等人設(shè)計(jì)了一種具有優(yōu)異生物相容性的鉍基金冠吡啶納米平臺(tái)(BACN),其可用于協(xié)同治療和實(shí)時(shí)成像。納米結(jié)構(gòu)的BACN與中藥BF結(jié)合形成多功能的抗腫瘤治療和診斷平臺(tái)。相關(guān)工作以“Gold-Crowned Bismuth-Based Nanocomposites for Sonodynamic, Photothermal, and Chemotherapeutic Cancer Therapy”為題發(fā)表在ACS Appl. Mater. Interfaces上。

【文章要點(diǎn)】
在這項(xiàng)研究中,研究團(tuán)隊(duì)選用毒性低且不與機(jī)體發(fā)生活性反應(yīng),同時(shí)具有高X射線衰減系數(shù)、高近紅外吸收和良好的抗菌性能的鉍元素作為基底。通過(guò)配體交換對(duì)Bi NPs進(jìn)行修飾,將帶負(fù)電荷的Au NPs和吡啶分子通過(guò)靜電相互作用組裝在帶正電荷的Bi NPs周?chē)纬葿ACN。由于組裝了金納米粒子和吡啶,納米平臺(tái)起到藥物遞送載體、聲敏劑和光熱劑的作用。研究以中藥BF作為模型藥物,以期達(dá)到加速血流、化瘀、解熱、解毒之作用。重要的是,Bi存在于BACN中,具有較高的X射線質(zhì)量衰減系數(shù)。這使得能夠進(jìn)行診斷成像,用作計(jì)算機(jī)斷層掃描/光聲(CT/PA)成像的造影劑,并且可能指導(dǎo)協(xié)同PTT/SDT。(圖1)
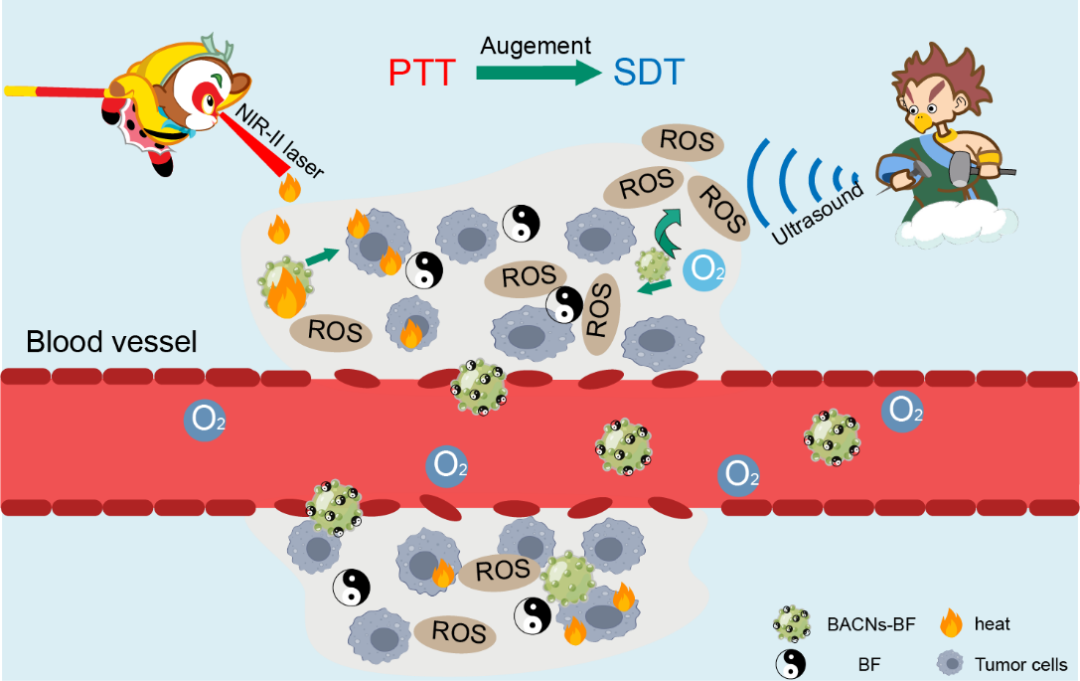
圖1 PTT/SDT聯(lián)合驅(qū)動(dòng)下BACN-BF的抗腫瘤模式
聲和光是自然界中最常見(jiàn)的現(xiàn)象,聲和光可以激活各種變化,包括物理效應(yīng)、化學(xué)反應(yīng)或生物能量轉(zhuǎn)換等。鉍基納米平臺(tái)在NIR區(qū)域表現(xiàn)出表面等離子共振和高吸收率,促進(jìn)了電荷載流子轉(zhuǎn)移和電子俘獲,可有效地抑制電子-空穴復(fù)合。由于電荷載流子的壽命延長(zhǎng),形成了大量強(qiáng)氧化能力的自由基,包括1O2、O2·-和·OH。研究首先探索了BACN在NIR-II區(qū)域的光熱性能,發(fā)現(xiàn)其具有優(yōu)異的光熱轉(zhuǎn)換效率。研究通過(guò)多種方法分析,評(píng)估BACN在外部US輻照下可產(chǎn)生較強(qiáng)氧化能力的自由基。在體外實(shí)驗(yàn)中,通過(guò)二氯二氫熒光素進(jìn)行定量、以及WST-1和對(duì)細(xì)胞內(nèi)谷胱甘肽分析,發(fā)現(xiàn)US特異性增強(qiáng)了NIR-II激光照射后ROS的產(chǎn)生,其產(chǎn)生的熱量促進(jìn)了電子和空穴的分離,促進(jìn)了聲催化。(圖2)

圖2 在BACN介導(dǎo)的SDT/PTT協(xié)同作用
中醫(yī)典籍多記載蟾酥能治療“惡瘡”、“惡腫”、“積塊”,即現(xiàn)代醫(yī)學(xué)研究中的抗腫瘤作用。研究將中藥BF作為模型藥物,以期達(dá)到加速血流、化瘀、解熱、解毒之作用。體內(nèi)實(shí)驗(yàn)結(jié)果表明BACN-BF納米遞送平臺(tái)完全根除了腫瘤,同時(shí)具有良好的治療生物安全性和無(wú)明顯復(fù)發(fā)。在PTT治療期間,血流量顯著增加,氧氣供應(yīng)也隨之增加,從而增強(qiáng)了腫瘤細(xì)胞對(duì)氧氣依賴的SDT敏感性。同時(shí),由于干擾腫瘤生理學(xué)和微環(huán)境條件的擾動(dòng),SDT增加了癌細(xì)胞的熱敏感性,改善了PTT治療結(jié)果。利用這一點(diǎn),PTT和SDT的協(xié)同可以克服單一治療方式的固有局限性,同時(shí)還可以提高治療效率。重要地是,由于鉍元素卓越的X射線衰減能力及光吸收能力,表明BACN在CT/PA生物成像中的巨大潛力。(圖3)
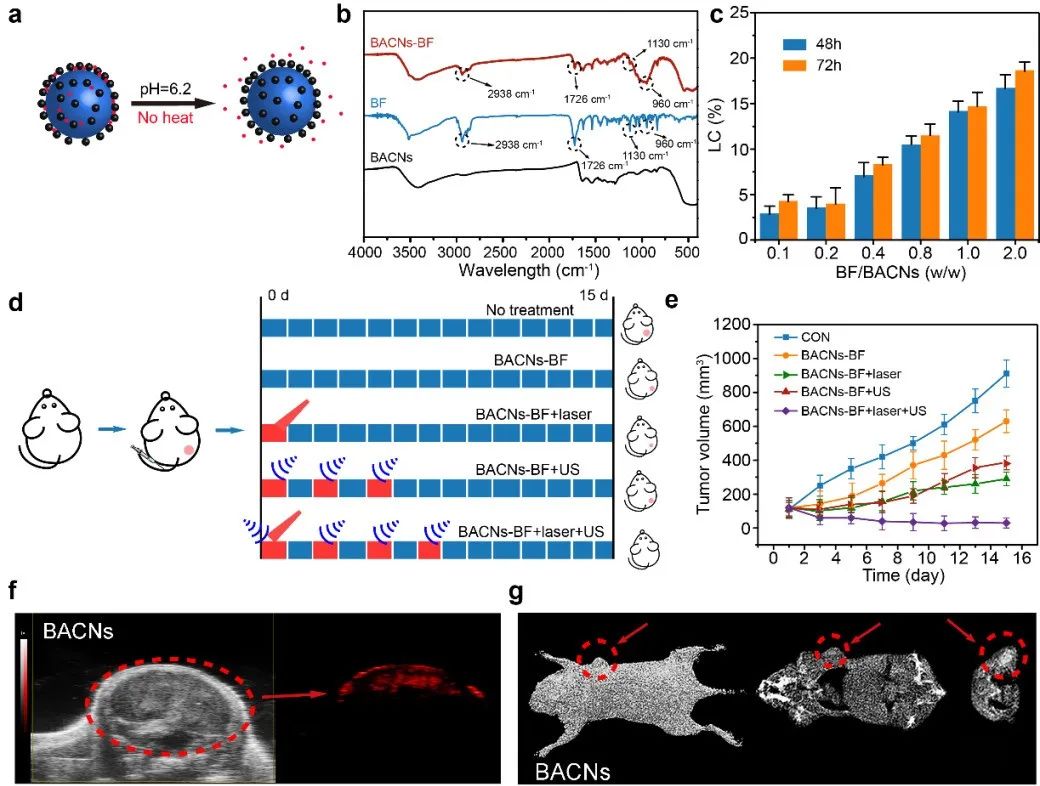
圖3 BACN的藥物負(fù)載和治療能力及診斷成像潛力
【結(jié)論與展望】
作者最后介紹道,耐藥性的發(fā)生、腫瘤復(fù)發(fā)、嚴(yán)重的副作用以及復(fù)雜的治療程序限制了一些治療方式的應(yīng)用。SDT和NIR-II PTT對(duì)深部組織疾病具有優(yōu)異的治療效果,但其協(xié)同治療理論和機(jī)制并不完善。中醫(yī)藥的加入可以“攻補(bǔ)兼施”與其他療法配合應(yīng)用,以提高機(jī)體抗病力,改善全身狀況和癥狀。隨著中醫(yī)藥的不斷發(fā)展及創(chuàng)新,SDT和PTT在癌癥的診斷和治療等方面,將會(huì)迎來(lái)重大突破。中醫(yī)藥與現(xiàn)代納米醫(yī)學(xué)的結(jié)合具有臨床轉(zhuǎn)化潛力,但仍處于臨床試驗(yàn)的早期階段。中醫(yī)藥的交叉融合符合中國(guó)國(guó)家重大戰(zhàn)略和中醫(yī)藥行業(yè)產(chǎn)業(yè)發(fā)展需求。本研究將中醫(yī)藥、納米醫(yī)學(xué)、超聲醫(yī)學(xué)、光學(xué)交叉融合,克服單一治療方式的固有局限性,實(shí)現(xiàn)了精準(zhǔn)、安全、有效的中藥研究新技術(shù)與新方法。


 訂閱號(hào)
訂閱號(hào)
 公眾號(hào)
公眾號(hào)